\\ Home Page : Articolo
HANNO SUPPORTATO DIGITAL WORLDS INVIANDO PRODOTTI DA RECENSIRE
 |
 |
|
 |
|
Stampa 3D di organi: il bioprinting rivoluziona la medicina rigenerativa
Di Alex (del 28/01/2026 @ 14:40:00, in Tecnologia, letto 58 volte)
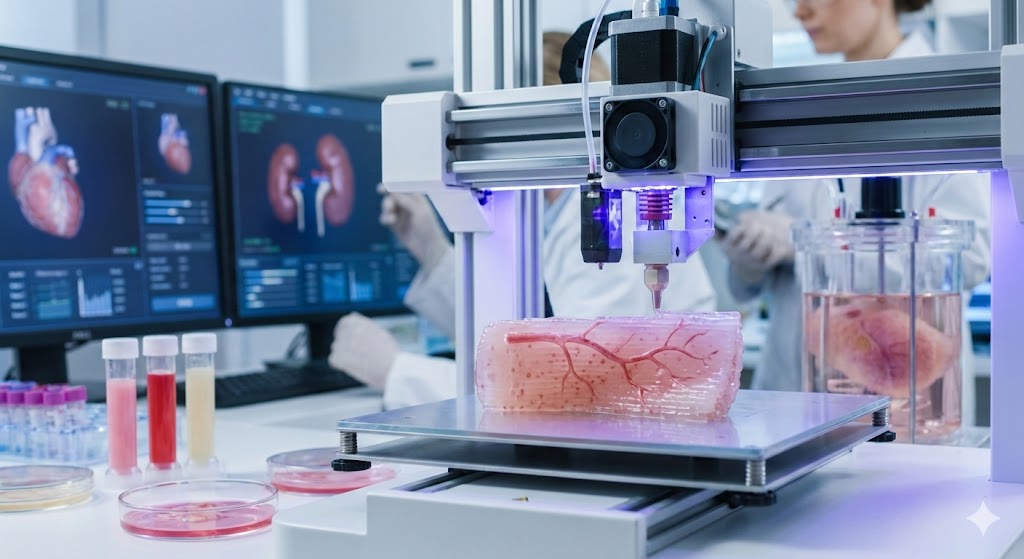
Una biostampante 3D in azione mentre crea strati di tessuto vascolarizzato utilizzando bioink contenente cellule umane viventi
Il bioprinting permette di stampare tessuti e organi funzionali usando cellule del paziente, eliminando il rigetto e le liste d'attesa per trapianti. Questa tecnologia combina stampanti 3D specializzate con bioink cellulare per creare strutture vascolarizzate che potrebbero rivoluzionare la medicina. LEGGI TUTTO L'ARTICOLO
La crisi globale dei trapianti d'organo
Ogni anno, centinaia di migliaia di pazienti in tutto il mondo attendono disperatamente un trapianto d'organo che potrebbe salvargli la vita. Le liste d'attesa crescono costantemente, mentre la disponibilità di organi compatibili rimane tragicamente limitata. Secondo le statistiche sanitarie globali, meno del venti per cento dei pazienti in lista d'attesa riceve effettivamente l'organo di cui ha bisogno, e migliaia muoiono prima che arrivi il loro turno.
Anche quando un organo compatibile viene trovato, i problemi non finiscono. Il rigetto immunologico rappresenta una minaccia costante: il sistema immunitario del ricevente riconosce l'organo trapiantato come estraneo e tenta di distruggerlo. I pazienti trapiantati devono assumere farmaci immunosoppressori per tutta la vita, con conseguenze devastanti sulla qualità della vita e rischi significativi di infezioni, tumori e altri effetti collaterali gravi.
La medicina rigenerativa promette di rovesciare completamente questo paradigma. Invece di attendere un donatore compatibile, la visione è quella di creare organi su misura utilizzando le cellule dello stesso paziente, eliminando sia il problema della scarsità che quello del rigetto. Il bioprinting tridimensionale rappresenta la tecnologia più promettente per realizzare questa rivoluzione medica.
Come funziona il bioprinting di tessuti e organi
Il bioprinting è un processo straordinariamente complesso che combina principi di ingegneria, biologia cellulare, scienza dei materiali e informatica. A differenza della stampa 3D tradizionale che utilizza plastica o metallo, il bioprinting lavora con materiali biologici viventi che devono sopravvivere e prosperare dopo la stampa.
Il processo inizia con la creazione di un modello digitale tridimensionale dell'organo o del tessuto da stampare. Questo modello viene generato attraverso tecniche di imaging medico avanzate come la tomografia computerizzata o la risonanza magnetica, che catturano la struttura anatomica precisa dell'organo del paziente. Software specializzati convertono poi queste immagini in istruzioni dettagliate per la biostampante.
Il materiale di stampa, chiamato bioink, è forse l'elemento più critico dell'intero processo. Il bioink è una sospensione complessa che contiene cellule viventi del paziente, generalmente cellule staminali o cellule specializzate prelevate tramite biopsia, mescolate con una matrice di supporto biologicamente compatibile. Questa matrice, chiamata idrogel, fornisce supporto strutturale alle cellule durante e dopo la stampa, mantenendole vitali e permettendo loro di ricevere nutrienti e ossigeno.
Gli idrogel utilizzati nel bioprinting sono tipicamente composti da materiali naturali come collagene, alginato, gelatina o acido ialuronico, tutte sostanze già presenti naturalmente nel corpo umano. La composizione precisa dell'idrogel viene ottimizzata per ogni tipo di tessuto: tessuti molli come il fegato richiedono idrogel più morbidi, mentre tessuti come la cartilagine necessitano di matrici più rigide.
La biostampante deposita il bioink strato dopo strato, seguendo il modello digitale con precisione micrometrica. Le tecnologie di bioprinting più comuni includono l'estrusione, dove il bioink viene spinto attraverso un ugello come una siringa, la stampa a getto d'inchiostro, che spruzza goccioline di bioink, e la stereolitografia, che utilizza luce ultravioletta per solidificare selettivamente il bioink fotosensibile.
Dopo la stampa, il tessuto o l'organo deve essere maturato in un bioreattore, un ambiente controllato che simula le condizioni fisiologiche del corpo umano. Il bioreattore fornisce nutrienti, ossigeno, e stimolazione meccanica appropriata, permettendo alle cellule di moltiplicarsi, differenziarsi nei tipi cellulari corretti e organizzarsi nella struttura funzionale desiderata. Questo processo può richiedere settimane o mesi a seconda della complessità del tessuto.
La sfida critica della vascolarizzazione
Il principale ostacolo tecnico che ha ritardato per anni il bioprinting di organi complessi è la vascolarizzazione, ovvero la creazione di una rete di vasi sanguigni funzionanti all'interno del tessuto stampato. Qualsiasi tessuto più spesso di pochi millimetri richiede vasi sanguigni per fornire ossigeno e nutrienti alle cellule interne e rimuovere i prodotti di scarto metabolico.
Senza una rete vascolare adeguata, le cellule al centro di un organo stampato muoiono rapidamente per mancanza di ossigeno, anche se l'organo è perfettamente strutturato dal punto di vista anatomico. Questo problema ha limitato per anni il bioprinting alla creazione di tessuti sottili e relativamente semplici come pelle o cartilagine.
Negli ultimi cinque anni, tuttavia, sono stati compiuti progressi rivoluzionari nella stampa di reti vascolari. Diverse strategie innovative sono state sviluppate e perfezionate. Una tecnica particolarmente promettente prevede la stampa di canali cavi all'interno del tessuto utilizzando materiali sacrificali che vengono successivamente rimossi chimicamente, lasciando una rete di tunnel che vengono poi rivestiti con cellule endoteliali per formare vasi sanguigni funzionanti.
Un altro approccio sfrutta la capacità intrinseca delle cellule endoteliali di auto-organizzarsi in strutture capillari quando poste nelle condizioni appropriate. I ricercatori stampano queste cellule insieme al bioink principale e poi stimolano la formazione spontanea di reti capillari attraverso fattori di crescita specifici e condizioni meccaniche appropriate nel bioreattore.
Recentemente, alcuni laboratori hanno sviluppato tecniche di stampa multi-materiale ad altissima risoluzione che possono depositare simultaneamente diversi tipi di bioink, creando in un'unica sessione di stampa sia il tessuto principale che la sua rete vascolare integrata. Queste stampanti di nuova generazione utilizzano decine di ugelli indipendenti che lavorano in parallelo con precisione submillimetrica.
Successi recenti e applicazioni cliniche emergenti
Sebbene il bioprinting di organi completi e completamente funzionali rimanga ancora un obiettivo futuro, progressi straordinari sono stati raggiunti nella stampa di tessuti più semplici e di modelli organici funzionali. Diversi prodotti di bioprinting hanno già ricevuto approvazioni regolatorie e sono utilizzati clinicamente o in fase di sperimentazione avanzata.
La pelle biostampata rappresenta uno dei successi più concreti. Diverse aziende hanno sviluppato sistemi di bioprinting portatili che possono stampare strati di pelle direttamente sulle ferite di pazienti ustionati. Questi dispositivi utilizzano cellule della pelle del paziente stesso o cellule staminali modificate, creando innesti cutanei personalizzati che si integrano perfettamente con la pelle circostante senza rigetto.
Nel campo della cartilagine, il bioprinting ha prodotto risultati eccellenti. Cartilagine stampata utilizzando condrociti del paziente è stata impiantata con successo in ginocchia danneggiate, riparando lesioni che tradizionalmente avrebbero richiesto protesi metalliche o innesti da cadavere. La cartilagine biostampata matura in un tessuto praticamente indistinguibile dalla cartilagine naturale.
Il tessuto osseo rappresenta un'altra area di successo significativo. Impianti ossei personalizzati stampati con cellule osteoblastiche del paziente mescolate con fosfato di calcio biocompatibile hanno dimostrato capacità di integrazione eccellenti. Questi impianti sono particolarmente preziosi in chirurgia maxillo-facciale e ricostruttiva, dove la geometria complessa rende difficili gli approcci tradizionali.
Tessuti più complessi come il fegato stanno mostrando progressi promettenti. Ricercatori hanno stampato mini-fegati funzionali, chiamati organoidi epatici, che dimostrano funzionalità metaboliche caratteristiche del fegato reale. Questi organoidi non sono ancora abbastanza grandi o complessi per sostituire un fegato intero, ma vengono utilizzati come modelli per testare farmaci, studiare malattie epatiche e potenzialmente come supporto temporaneo per pazienti in attesa di trapianto.
Il cuore rappresenta forse la sfida più ambiziosa. Nel duemila diciannove, ricercatori israeliani stamparono il primo cuore umano in miniatura completo di camere, vasi sanguigni e cellule cardiache funzionanti. Sebbene delle dimensioni di una ciliegia e non ancora impiantabile, questo risultato dimostrò che la geometria complessa di un organo vitale può essere replicata attraverso il bioprinting.
Le implicazioni etiche e sociali della tecnologia
Il bioprinting solleva questioni etiche profonde che la società sta ancora iniziando ad affrontare. La capacità di creare organi umani in laboratorio tocca temi fondamentali relativi alla natura della vita, all'identità personale e alla giustizia distributiva nell'accesso alle cure mediche.
Una preoccupazione immediata riguarda l'accessibilità economica. Le prime applicazioni del bioprinting saranno inevitabilmente estremamente costose, richiedendo attrezzature sofisticate, personale altamente specializzato e materiali biologici costosi. Questo rischia di creare una disparità sanitaria dove solo i pazienti più ricchi possono permettersi organi biostampati personalizzati, mentre altri rimangono nelle liste d'attesa tradizionali.
La questione del consenso informato diventa particolarmente complessa nel bioprinting. Le cellule utilizzate vengono prelevate dal paziente, ma una volta coltivate e moltiplicate in laboratorio, a chi appartengono? Il paziente mantiene diritti di proprietà sui tessuti derivati dalle sue cellule? Cosa succede se questi tessuti vengono utilizzati per ricerca o applicazioni commerciali non previste inizialmente?
Un dibattito etico emerge anche riguardo ai limiti di cosa dovrebbe essere stampato. Mentre c'è consenso generale sulla legittimità di stampare organi vitali per salvare vite, questioni più controverse sorgono considerando applicazioni cosmetiche o di potenziamento. Dovrebbe essere permesso stampare tessuti per alterare l'aspetto estetico oltre la ricostruzione post-traumatica? E organi sensoriali potenziati che superano le capacità umane normali?
La regolamentazione del bioprinting rappresenta una sfida per le autorità sanitarie globali. I tessuti biostampati non si inseriscono facilmente nelle categorie regolatorie esistenti: non sono farmaci, non sono dispositivi medici tradizionali, e non sono trapianti da donatore. Nuovi framework regolatori devono essere sviluppati per garantire sicurezza ed efficacia senza soffocare l'innovazione.
Il futuro della medicina rigenerativa personalizzata
Guardando ai prossimi dieci-vent'anni, gli esperti prevedono progressi trasformativi nel bioprinting che potrebbero ridefinire completamente la pratica medica. La visione più ambiziosa è quella di ospedali dotati di biostampanti dove organi personalizzati possono essere prodotti su richiesta in pochi giorni o settimane per pazienti specifici.
La convergenza del bioprinting con altre tecnologie emergenti promette possibilità ancora più rivoluzionarie. L'intelligenza artificiale sta già venendo integrata per ottimizzare automaticamente i parametri di stampa, prevedere come i tessuti matureranno e personalizzare i progetti in base alla fisiologia unica di ogni paziente. Algoritmi di apprendimento automatico analizzano migliaia di stampe precedenti per perfezionare continuamente il processo.
La biologia sintetica potrebbe permettere la creazione di cellule ingegnerizzate con funzionalità potenziate. Invece di replicare semplicemente organi naturali, potremmo stampare organi migliorati resistenti a malattie, invecchiamento o danni ambientali. Un fegato ingegnerizzato potrebbe metabolizzare tossine più efficacemente, o reni potenziati potrebbero filtrare il sangue con maggiore efficienza.
La miniaturizzazione della tecnologia di bioprinting potrebbe portare a dispositivi portatili utilizzabili direttamente in sala operatoria o addirittura sul campo in situazioni di emergenza. Stampanti delle dimensioni di una valigia potrebbero permettere ai chirurghi di creare innesti tissutali personalizzati durante l'intervento stesso, riparando danni traumatici con tessuto del paziente stampato al momento.
L'integrazione con la robotica chirurgica potrebbe permettere procedure dove il bioprinting avviene direttamente all'interno del corpo del paziente. Micro-robot iniettabili equipaggiati con capacità di bioprinting potrebbero navigare attraverso i vasi sanguigni fino al sito di un danno e depositare cellule terapeutiche con precisione, riparando tessuti danneggiati dall'interno senza chirurgia invasiva.
La convergenza del bioprinting con la medicina di precisione basata sulla genomica personale porterà a trattamenti iper-personalizzati. Il profilo genetico completo di un paziente informerà non solo quali cellule utilizzare, ma anche come modificarle geneticamente per correggere predisposizioni a malattie prima di stampare l'organo sostitutivo.
Gli ostacoli tecnici ancora da superare
Nonostante l'entusiasmo e i progressi reali, ostacoli tecnici significativi separano ancora la tecnologia attuale dalla visione futuristica di organi completamente funzionali stampati su richiesta. La complessità biologica di organi come il fegato, i reni o i polmoni, che contengono dozzine di tipi cellulari diversi organizzati in architetture tridimensionali intricate, rimane formidabile.
La scalabilità rappresenta una sfida critica. Stampare un piccolo pezzo di tessuto epatico di pochi centimetri cubi è una cosa; stampare un fegato intero funzionale del peso di un chilogrammo e mezzo con miliardi di cellule perfettamente organizzate è un'altra completamente diversa. Il tempo richiesto cresce esponenzialmente con le dimensioni, e mantenere vitali le cellule già stampate mentre si completano gli strati successivi diventa sempre più difficile.
L'innervazione, ovvero l'integrazione del tessuto stampato con il sistema nervoso del ricevente, rimane largamente irrisolta. Gli organi naturali sono densamente innervati da nervi che controllano le loro funzioni e trasmettono segnali sensoriali. Replicare questa rete nervosa complessa attraverso il bioprinting e far sì che si integri correttamente con i nervi del ricevente rappresenta una frontiera ancora pionieristica.
La maturazione funzionale completa dei tessuti stampati richiede tempo e condizioni ancora non completamente comprese. Un organo stampato potrebbe avere la struttura anatomica corretta ma mancare della piena funzionalità fisiologica. Comprendere e replicare i segnali biochimici e meccanici che guidano la maturazione tissutale durante lo sviluppo embrionale rappresenta un'area di ricerca intensa.
Il bioprinting di organi rappresenta una delle frontiere più promettenti e affascinanti della medicina moderna. Sebbene organi completi pienamente funzionali rimangano ancora un obiettivo futuro, i progressi compiuti nell'ultimo decennio sono stati straordinari. Dalla pelle biostampata già in uso clinico ai mini-organi funzionali che servono come modelli di malattia, questa tecnologia sta già cambiando vite. Nei prossimi decenni, potrebbe eliminare completamente le liste d'attesa per trapianti, trasformando la medicina rigenerativa da promessa futuristica a realtà quotidiana negli ospedali di tutto il mondo.
Nessun commento trovato.
Disclaimer
L'indirizzo IP del mittente viene registrato, in ogni caso si raccomanda la buona educazione.
L'indirizzo IP del mittente viene registrato, in ogni caso si raccomanda la buona educazione.






 Think different!
Think different!






 Microsmeta Podcast
Microsmeta Podcast Feed Atom 0.3
Feed Atom 0.3





 Articolo
Articolo  Storico
Storico Stampa
Stampa